人類胚胎基因修復不再遙遠?糾正常見但致命的突變
據國外媒體報道,所謂的“設計嬰兒”(designer baby)可能不再是一件非常遙遠的事。2017年,我們見證了許多基因工程領域的新聞,其中大部分都涉及對基因片段進行剪切和粘...
據國外媒體報道,所謂的“設計嬰兒”(designer baby)可能不再是一件非常遙遠的事。2017年,我們見證了許多基因工程領域的新聞,其中大部分都涉及對基因片段進行剪切和粘貼(即基因編輯)的CRISPR技術。
最引人關注的一個新聞是,CRISPR可以修改人類胚胎,糾正一種相對常見且往往致命的突變。
從事這一前沿研究的是頗具爭議的美國細胞生物學家舒哈拉特·米塔利波夫(Shoukhrat Mitalipov)。他表示,他的團隊不僅使用CRISPR來修改新受精胚胎中的突變,而且所采用的機制如果不算新穎,至少也是非同尋常。科學界很快對此做出了直接且負面的反應。他們并不認同這一實驗。近日,在米塔利波夫曾發表最初成果的《自然》(Nature)雜志上,有兩組研究人員發表了對其2017年論文的尖銳批評——文中充滿了首字母縮寫詞和各種示意圖。米塔利波夫試圖做出回應,因為如果科學性不能保證的話,倫理問題就不那么重要了。
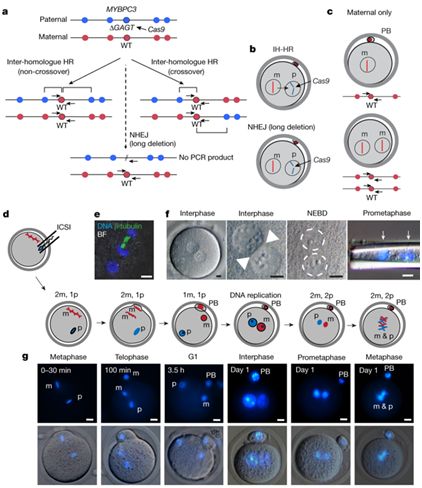
我們都知道嬰兒是怎么產生的,對吧?米塔利波夫的團隊并沒有以常規方法來獲得胚胎。在美國,利用已有的人類胚胎進行科學研究在絕大多數情況下是禁忌,因此科學家采用含有突變型MYBPC3基因的精子使正常人類卵子受精。這種突變基因會引發名為肥厚性心肌癥的疾病,而該疾病是導致年輕運動員猝死的最常見原因。具有兩份突變型MYBPC3基因拷貝——分別來自母親和父親,或者用遺傳學術語說,是同源的等位基因——的人很少能在兒童時期存活下來。只具有一份拷貝(雜合子)的人往往會隨年齡增長而出現心臟問題。
為了修正這一變異,米塔利波夫的團隊利用CRISPR技術將變異基因從父系染色體中剪切出來,然后插入一個合成的修改版本。不過,基因編輯的第二步并沒有發生。相反,根據米塔利波夫的分析,細胞復制了來自母體染色體的野生型基因,并將其插入到剪切位置。結果就是,胚胎具有兩個野生型等位基因。這一過程被稱為“同源依賴性修復”或“同源(基因)間修復”。
“一些作者一直在研究DNA修復,不知為何他們忽視了這頭房間里的大象(比喻問題因太過龐大或麻煩而沒有人愿意去碰),”在俄勒岡州衛生科學大學擔任胚胎細胞與基因治療中心主任的米塔利波夫說,“我們指的是基因修復領域中有一道巨大的知識鴻溝。我們不確定它是否發生在體細胞譜系中,但是在胚胎譜系中,我們現在已經證明了這一點。”
胚胎學家和細胞生物學家并不認為他們忽視了“大象”。他們認為所謂的“大象”并不存在。一篇批評文章的第一作者、南澳大利亞健康與醫學研究所SA基因組編輯主管保羅·托馬斯(Paul Thomas)說:“我們認為有另一種解釋。”托馬斯的工作顯示,在小鼠身上,CRISPR往往會從基因組中剪切出大塊的DNA,即所謂的“大段刪除”(large deletion)。他猜測米塔利波夫研究組的胚胎中也發生了同樣的過程,而他們忽視了大段刪除造成實驗失敗的可能。“如果染色體上發生了大段刪除,你就需要具體地分析這一事件,”托馬斯說,“如果你是用他們所用的檢測方法,一種非常標準的檢測方法,那就無法檢測出來。”
換句話說,這就像在一天結束之后,通過計算貨架上的東西來弄清楚面包店制作了多少種百吉餅。統計數據會告訴你,這家面包店主要制作藍莓口味,但這是因為像蒜香、加鹽和原味等口味在你統計之前就已經賣完了。你的統計會高估藍莓口味占所有百吉餅的比例。
這是否可能是小鼠和男性的問題?當然有可能。“很顯然,有越來越多的研究發現了小鼠胚胎中的大段刪除。尚不清楚的是,人類胚胎中是否也發生了大段刪除,目前我們只有屈指可數的一些研究結果,”托馬斯說道。
于是,米塔利波夫的團隊又回到了實驗室。他們將原先的樣品拿出來,重新進行了檢測。他們采用的是聚合酶鏈式反應(PCR)技術,可以對足夠大量的DNA進行測序和分析。這一次,他們分析了染色體中較長的一段。“我們的檢測使用了大規模PCR,檢測了超過10000個堿基對,但我們還是沒看到任何刪除,”米塔利波夫說道。他原本就不期待有什么發現。他的小組在第一篇論文中報告了修復基因突變的成功率大約為70%。米塔利波夫表示,很難相信他的研究中有70%的胚胎具有CRISPR引起的大段刪除;如果真的這樣,那這種技術就無法適用了。
事情并沒有就這么結束。“我們非常驚訝他們沒有在回應文章中提及的任何樣品中發現任何刪除的證據,”托馬斯說,“我們認為他們并沒有完全排除這種可能性。”托馬斯的論文合著者之一法特瓦·阿迪庫蘇馬(Fatwa Adikusuma)提出,更加精準的檢測方法——比如qPCR(能定量分析DNA的量)——或許可行。米塔利波夫還沒有嘗試過這種方法。
其他團隊也有各自的問題。例如,由哥倫比亞大學的迪亞特·艾格利(Dieter Egli)和紀念斯隆-凱特琳癌癥中心的瑪利亞·賈辛(Maria Jasin)所領導的研究小組(包括直言不諱的哈佛大學生物技術專家喬治·丘奇)關注了CRISPR復合體如何能獲得母體野生型基因的問題,因為早期的細胞分裂中,母體和父體的貢獻是分開的。米塔利波夫稱,原核中的親本DNA有足夠的接觸時間,使修復過程起作用。“如果這種說法是對的,那么這些胚胎中沒有出現更多的鑲嵌現象就很令人費解,”加州大學戴維斯分校的細胞生物學家保羅·諾福勒(Paul Knoepfler)說道。“鑲嵌”現象是指單個生物的不同細胞中具有不同的基因組。“CRISPR的介入時間太晚,比如在雙細胞胚胎階段,這很可能會導致不同的基因結果,”諾福勒說道。這些可能會在之后產生不太健康的胚胎。
所以,有沒有可能米塔利波夫是對的?瑪利亞·賈辛說:“正如論文中所說,新的數據與基因修復結果是一致的。”不過她也表示,米塔利波夫的回應表明了這類研究有多么困難。在他的研究中,有一個胚胎顯示出“等位基因脫扣”(allele dropout)的現象,即研究團隊無法在雙親中同時檢測到等位基因。瑪利亞·賈辛補充道:“我們不確定同源基因間重組引起的基因修復是否發生在所有胚胎中,或者部分胚胎中,或者在最極端情況下,沒有一個胚胎發生這樣的修復。”
包括米塔利波夫在內,所有人都表示,這一切還需要更多研究才能有確定答案。對他來說這沒有什么關系;他明白人們對他所說的話和所做的事都有很多擔憂。如果他的方法確實有效,那也只能適用于具有單個野生型基因拷貝的胚胎。一方面,細胞必須具有一個野生型基因版本才能復制。但更重要的是,新的想法需要更多時間和工作才能滲透到一個領域中。“現在有很多教條,特別是在生物學領域,”米塔利波夫說,“而我們帶著實驗結果闖入了這個領域,說這是人類胚胎中一種未知但十分強大的修復途徑。”
想讓“教條”為這種方法讓路顯然需要時間。“在某種程度上,米塔利波夫的團隊加強了他們的實例,”諾福勒說,“也許這指明了我們從根本上理解早期人類胚胎中新機制的方向,但也有可能在一年之后,我們將以完全不同的角度看待這一問題。”當然,無論哪種結果,對于最終的臨床實踐,都要求超過70%的成功率。這也意味著,科學家還需要在實驗室中進行更多的工作,努力使原本非常遙遠的事情變得更有現實可行性。(任天)

科學計算教你顯示器尺寸怎么選 顯示器多大尺寸合適?
隨著顯示器的不斷發展,如今顯示器屏幕尺寸越來越大,分辨率也越來越高。早今年主流大屏顯示器都是22英寸左右,如今都是23英寸、24英寸、27英寸,甚至有32英寸以上大屏顯示器。那么...
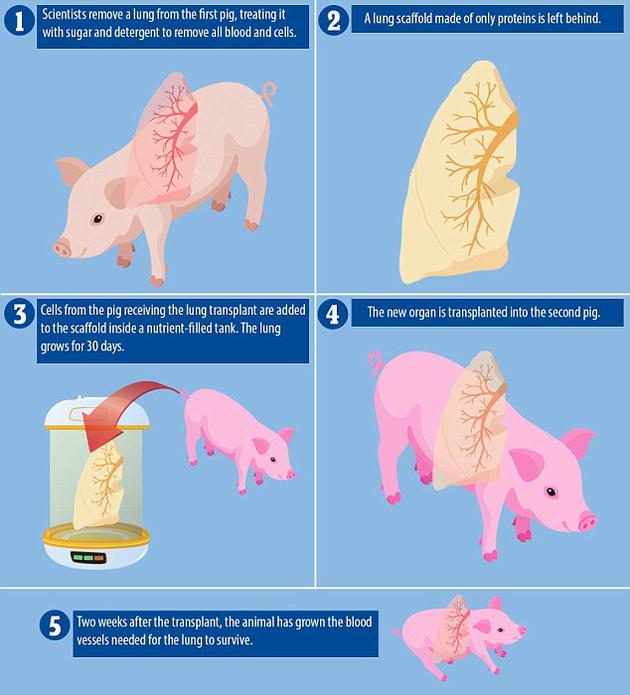
科學家使用豬細胞培育人造肺目前無器官排斥風險
北京時間8月6日消息,據國外媒體報道,目前美國接近1500名患者等待肺器官移植。但是捐獻者提供肺器官數量不夠,同時通過抑制受體免疫系統,使患者身體不排斥新器官是十分危險的。實...
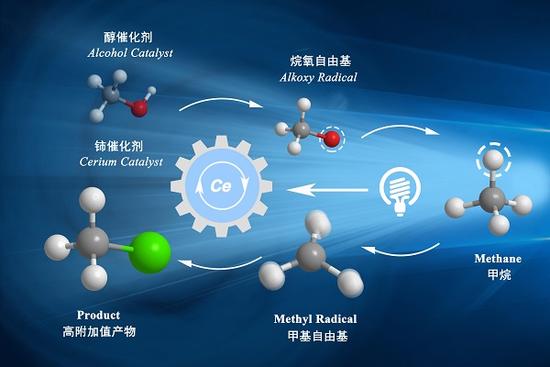
中國科學家發明新催化劑 馴服甲烷可做火箭燃料
甲烷,有機化學中最難被轉化的“頑固分子”。近日,上海科技大學物質科學與技術學院左智偉團隊破解了這一難題,他們找到了一個低成本、高效率的催化劑組合,室溫條件...

買顯卡要注意什么?科學看顯卡參數 避開這些雷區!
在我們日常DIY裝機中,顯卡的選擇往往讓很多人困惑。玩游戲的都知道顯卡的重要性,所以在購買的時候是謹慎又謹慎,對比再對比。下面小編給大家分享一些顯卡選購的實用技巧,理性分...

中國學生期望進入科學行業的比例僅16.8%
前不久,經濟合作與發展組織(OECD)公布2015年的國際學生能力測試(PISA)結果顯示,美國“將來期望進入科學相關行業從業的學生比例”為38%,中國只有16.8%,還不及OECD國家24.5%的均值。記者隨機以“長大后想做什么”調查身...

科學家借助AI技術找到更安全的電解質 或保電池不炸
在今天,各種電池爆炸事件鬧得沸沸揚揚,一時之間我們在使用鋰電池產品的時候都有點心慌。而就在近日,科學家聲稱已經找到了更安全的固體電解質,可以更有效地穩定鋰電池的內部結構。而幫助科學家們找到這一種電解質的,居然是AI技術。...

